안녕하세요. 학습코치 부이쌤입니다. 이번 시간에는 기체의 성질과 공식이라는 주제로 고등학교 과학탐구영역 화학1에 대한 이야기를 하도록 하겠습니다.

이번 주제는 2020년 6월 모의고사 18번 문항을 토대로 재구성하였으며, 기체의 성질과 질량, 부피, 분자량, 상대값 등을 구하는 공식에 대해 알아보겠습니다.
■제시문
18번 문항에서 표는 t도씨, 1기압에서 기체 (가)~(다)에 대한 자료로, 이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은?(단, X~Z는 임의의 원소 기호이고, t도씨, 1기압에서 기체 1mol의 부피는 24L이다.) 이라고 출제되었습니다.

기체 (가) : 분자식 XY2, 질량 18g, 부피 8L, 상대값 1
기체 (나) : 분자식 ZX2, 질량 23g, 부피 a, 상대값 1.5
기체 (다) : 분자식 Z2Y4, 질량 26g, 분자량 104, 상대랎 b
기체 (가), (나), (다)의 부피와 분자량을 구하여 비교한 다음 옳은 내용을 <보기>에서 고르면 되겠습니다.
■기체
기체는 물질의 네 가지 상태인 고체, 액체, 기체, 플라즈마 중 하나로, 순물질의 경우 기체는 같은 종류의 분자로 구성되어 있을 수 있고, 공기와 같이 서로 다른 기체들이 혼합물로 존재할 수 있습니다.

기체는 고체나 액체보다 밀도가 낮고, 일정한 모양과 부피를 가지지 않고 용기 안에서 확산하여 용기 속을 균일하게 가득 채우는데, 이는 고체, 액체 상태를 구성하는 입자들이 아주 가까이 위치한 데 비해, 기체 입자들 사이의 거리가 매우 크기 때문입니다.
기체는 구성하는 입자들 사이의 거리가 매우 커서 가볍고, 압축하기 쉽습니다. 그래서 기체를 이루고 있는 입자들은 공간 속을 자유롭게 날아다니고 있습니다.
기체의 압력은 기체의 용기 벽의 단위 면적에 가하는 힘으로 단위로는 pa, torr, psi 등이 있습니다. 부피는 V, m3제곱, L가 있으며, 온도는 T로 표시합니다.
■질량, 부피, 분자량, 전체 원자수 공식
기체 1mol의 부피는 0도씨, 1기압에서 모든 기체 1mol의 부피는 22.4L로 일정하며, 기체 22.4L 속에는 6.02*10의 23제곱 개의 기체 분자가 들어 있습니다. (기체 1mol의 부피 = 22.4L)
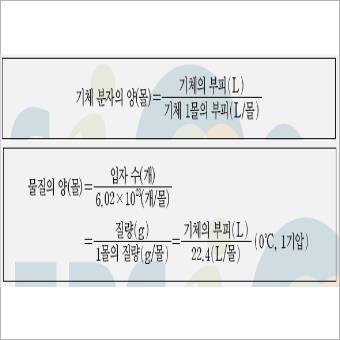
기체 분자의 양은 기체의 부피(L)/기체 1mol의 부피(L/물)로, 20도씨의 1기압에서 기체 1몰의 부피가 24L일 때, 12L에 포함된 기체 분자의 양은 12L/24L로 0.5몰임을 계산할 수 있습니다.
기체의 밀도와 분자량에서 같은 온도와 압력에서 같은 부피의 기체에 포함된 분자 수가 같고, 밀도는 질량/부피 이므로 기체의 밀도는 분자량에 비례합니다. 분자량이 32, 메테인의 분자량이 16이므로 20도씨, 1기압에서 산소 기체의 밀도가 4/3 g/L이면 메테인 기체의 밀도는 4/3 g/L * 1/2 = 2/3 g/L입니다.
기체의 양과 입자수, 질량, 부피 사이의 관계를 알아보겠습니다. 물질의 양은 입자 수/ 6.02*10의 23제곱이며 = 질량/1몰의 질량(g/물) = 기체의 부피(L)/22.4(L/물)과 같습니다. 예를 들어 C3H6, 분자량 30, 기체 2몰의 분자수는 2*6.02*10의 23제곱, 질량은 2*30g, 기체의 부피 2*22.4L(0도씨, 1기압)입니다.
■정리

t도씨, 1기압에서 기체 1 몰의 부피는 24L이고 (가)의 부피는 8L이므로 (가)의 양은 1/3 몰입니다.
ㄱ. (가)의 전체 원자의 양은 1/3 * 3 = 1몰이므로 (나)의 전체 원자의 양은 1.5 몰입니다. ZX2는 분자 당 원자 수가 3이므로 (나)의 양은 1.5 / 3 = 0.5 몰입니다. 따라서 (나)의 부피는 12 L이므로 a=12입니다. (다)의 양은 26 / 104 = 1/4 몰이고 Z2Y4는 분자 당 원자 수가 6이므로 전체 원자의 양은 3 /2 몰입니다. 따라서 (다)의 전체 원자 수는 1.5이므로 b=1.5입니다. a=12, b=1.5 이므로 a*b=18입니다.
ㄴ. (나) 0.5 몰의 질량은 23g이므로 (나) 1몰의 질량은 46g입니다. 1몰의 질량은 g과 같으므로 (나)의 분자량은 46입니다. 따라서 1g에 들어 있는 전체 원자 수는 (나)가 1/46*3, (다)가 1/104*6이므로 (나)>(다)입니다.
ㄷ. (가) 1/3 몰의 질량은 18g이므로 (가) 1몰의 질량은 54g이며 분자량은 54입니다. X~Z의 원자량을 각각 x~z라고 할 때 분자량은 구성 원자의 원자량의 합과 같으므로 x+2y-54, 2x+z=46, 4y+2y=104 이 식을 연립하면 x=16, y=19, z=14가 됩니다. 따라서 t도씨, 1기압에서 x2 6L는 1/4몰이므로질량은 1/4*32=8g입니다.
■마치며
지금까지 기체의 성질과 공식이라는 주제로 화학에 대해 배워봤는데, 이과는 이과입니다. 문과 출신이라 정리하는 것도 엄청 어려웠는데요. 확실히 뭐가 중요하고 뭐가 필요한지를 잘 캐치해야 되는 것 같습니다. 다음 시간부터는 간단하고 쉽게 설명하도록 하겠습니다. 지금까지 학습코치 부이쌤이었습니다.^^
'그외 > 과학탐구' 카테고리의 다른 글
| 별의 분광형에 따른 스펙트럼 (0) | 2020.06.26 |
|---|---|
| 체온 유지 원리와 체온 조절 과정 (6) | 2020.06.25 |
| 전자기파의 종류와 이용 (4) | 2020.06.25 |
| 대사성 질환과 당뇨병, 고혈압, 고지혈증, 대사 증후군의 의미와 원인 (9) | 2020.06.15 |
| 힘과 힘의 합성, 힘의 평형, 뉴턴 운동 법칙의 세 가지 (18) | 2020.06.15 |



